Mở đầu: Ở nhiệt độ thường, những kim loại nào có thể phản ứng được với dung dịch HCl 1 M, những kim loại nào có thể phản ứng được với H2O để tạo ra H2? Giải thích.
Lời giải:
Ở nhiệt độ thường:
- Những kim loại có thể phản ứng được với dung dịch HCl 1 M là: Li, K, Ba, Ca, Na, Mg, Al, Zn, Cr, Fe, Ni, Sn, Pb…
- Những kim loại có thể phản ứng được với H2O để tạo ra H2 là: Li, K, Ba, Ca, Na…
Giải thích:
- Trong môi trường trung tính, có:
2H2O + 2e ⇌ H2 + 2OH- với = – 0,413 V
Cặp oxi hóa – khử Mn+/M của các kim loại Li, K, Ba, Ca, Na có giá trị thế điện cực chuẩn nhỏ hơn – 0,413 V nên các kim loại đó có thể tác dụng với nước ở nhiệt độ thường tạo thành hydroxide và khí hydrogen.
- Trong môi trường acid, có:
2H+ + 2e ⟶ H2 với = 0 V
Cặp oxi hóa – khử Mn+/M của các kim loại Li, K, Ba, Ca, Na, Mg, Al, Zn, Cr, Fe, Ni, Sn, Pb có thế điện cực chuẩn nhỏ hơn 0 V có thể khử được ion H+ trong dung dịch acid tạo thành khí H2.
Cần nhớ:
- Mg phản ứng rất chậm với nước ở nhiệt độ thường, phản ứng nhanh hơn khi đun nóng.
- Al tác dụng được với nước. Tuy nhiên, phản ứng nhanh chóng dừng lại vì sản phẩm hydroxide không tan ngăn cản nhôm phản ứng với nước.
I. Tác dụng với phi kim
Câu hỏi 1: Dựa vào Bảng 10.1, hãy sắp xếp các kim loại sau đây theo chiều giảm dần tính khử: Al, Na, K, Fe, Cu.
Lời giải:
- Chiều giảm dần tính khử của các kim loại trên: K, Na, Al, Fe, Cu.
Luyện tập 1: Viết phương trình hóa học của phản ứng giữa kim loại kẽm với mỗi chất sau: oxygen, sulfur va chlorine.
Lời giải:
2Zn(s) + O2 (g) 2ZnO(s)
Zn(s) + S (s) ZnS(s)
Zn(s) + Cl2 (g) ZnCl2(s)
Thí nghiệm 1: Kim loại tác dụng với oxygen trong không khí
Chuẩn bị:
- Hoá chất: Băng magnesium dài khoảng 3 cm - 5 cm.
- Dụng cụ: Đèn cồn, bật lửa, kẹp đốt hoá chất.
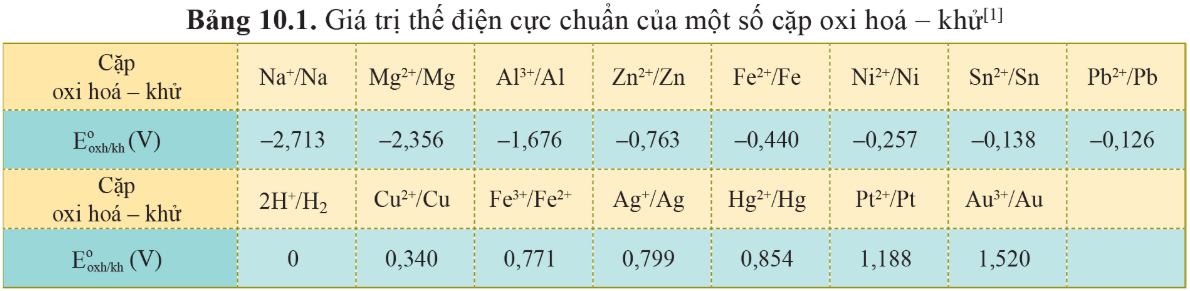
Tiến hành: Dùng kẹp đốt hoá chất đưa đoạn băng magnesium vào ngọn lửa đèn cồn.
Yêu cầu: Quan sát và giải thích hiện tượng, viết phương trình hoá học của phản ứng xảy ra.
Lời giải:
Khi băng magnesium đốt trong không khí, phát ra ánh sáng chói.
Mg đã tác dụng với khí oxygen.
III. Tác dụng với dung dịch muối
Thí nghiệm 2: Phản ứng của kim loại với dung dịch muối
Chuẩn bị:
- Hoá chất: Đinh sắt đã được đánh sạch bề mặt, dung dịch copper(II) sulfate 1 M.
- Dụng cụ: Cốc thuỷ tinh.
Tiến hành: Cho đinh sắt vào cốc thuỷ tinh chứa dung dịch copper(II) sulfate 1 M.
Yêu cầu: Sau khoảng 10 phút, quan sát, mô tả hiện tượng và giải thích.
Lời giải:
- Sau khoảng 10 phút, ta thấy dung dịch màu xanh ban đầu dần nhạt đi, phần bị ngâm trong dung dịch của đinh sắt có lớp kim loại màu nâu đỏ bám lên. Do Fe đã đẩy Cu ra khỏi dung dịch muối CuSO4 để tạo thành muối mới và Cu bị đẩy ra đã bám lên Fe.
![]()
Luyện tập 2: Cho = −2,925 V, = 0,854 V.
a) Cho biết vì sao potassium phản ứng được với nước. Viết phương trình hóa học của phản ứng xảy ra.
b) Giải thích vì sao thuỷ ngân không phản ứng được với nước để tạo hydroxide và khí hydrogen.
Lời giải:

IV. Tác dụng với dung dịch acid
Thí nghiệm 3: Phản ứng của kim loại với dung dịch hydrochloric acid
Chuẩn bị:
- Hoá chất: Lá đồng, băng magnesium, dung dịch hydrochloric acid 1 M.
- Dụng cụ: Ống nghiệm.
Tiến hành: Cho vào hai ống nghiệm mỗi ống khoảng 2 mL dung dịch HCl 1 M. Cho tiếp là đồng vào ống nghiệm (1), băng magnesium vào ống nghiệm (2).
Yêu cầu: Quan sát, mô tả hiện tượng xảy ra và viết phương trình hoá học của phản ứng.
Lời giải:
- Hiện tượng: Ở ống nghiệm (1) không có hiện tượng xảy ra. Ở ống nghiệm (2) thấy sủi bọt khí không màu, băng magnesium tan dần.
- Giải thích: Lá đồng không phản ứng với dung dịch hydrochloric acid. Băng magnesium phản ứng với dung dịch hydrochloric acid giải phóng khí hydrogen.
+ Phương trình hóa học: Mg(s) + 2HCl (aq) ⟶ MgCl2 (aq)+ H2(g)
Thí nghiệm 4: Phản ứng của kim loại với dung dịch sulfuric acid loãng, dung dịch sulfuric acid đặc, nóng
Chuẩn bị:
- Hoá chất: Lá đồng, dung dịch sulfuric acid 1 M, dung dịch sulfuric acid khoảng 70%, giấy quỳ.
- Dụng cụ: Ống nghiệm, kẹp ống nghiệm, bông tẩm nước, đèn cồn, bật lửa.
Tiến hành:
- Cho vào mỗi ống nghiệm chứa dung dịch sulfuric acid loãng và ống nghiệm chứa dung dịch sulfuric acid đặc một lá đồng.
- Đậy mỗi ống nghiệm bằng bông tẩm nước.
- Đun hai ống nghiệm trên ngọn lửa đèn cồn. Sau một thời gian, dùng mẫu giấy quỳ kiểm tra pH của bông tẩm nước đã dùng để nút hai ống nghiệm trên.
Yêu cầu: Quan sát, mô tả hiện tượng và giải thích. Viết phương trình hoá học của phản ứng xảy ra (nếu có).
Chú ý: Cẩn thận khi sử dụng dung dịch sulfuric acid đặc.
Lời giải:
- Ở ống nghiệm chứa dung dịch sulfuric acid loãng: Không có hiện tượng gì xảy ra.
- Ở ống nghiệm chứa dung dịch sulfuric acid đặc: Lá đồng tan dần và có bọt khí thoát ra. Khi cho khí vừa sinh ra thấm vào bông tẩm nước mà dùng giấy quỳ kiểm tra, ta thấy giấy quỳ chuyển sang màu hồng.
![]()
Câu hỏi 2: Dựa vào thế điện cực chuẩn của kim loại trong Bảng 10.1, giải thích vì sao Cu và Ag không phản ứng với dung dịch hydrochloric acid 1 M.
Lời giải:
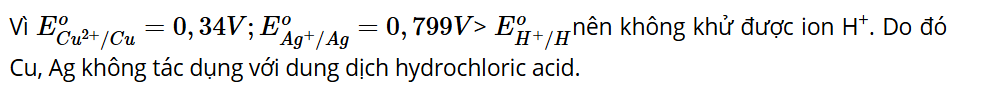
Luyện tập 3: Có thể dùng dung dịch sulfuric acid đặc để phân biệt đoạn dây bạc và đoạn dây platinum được không? Vì sao?
Lời giải:
Có thể dùng dung dịch sulfuric acid đặc để phân biệt đoạn dây bạc và đoạn dây platinum được.
Vì:
+ Bạc tác dụng được với dung dịch sulfuric acid đặc cho hiện tượng sủi bọt khí và dung dịch xuất hiện vẩn đục trắng.
2Ag(s)+ 2H2SO4(aq) Ag2SO4(s)+ SO2(g)+ 2H2O(l)
+ Platinum không tác dụng được với dung dịch sulfuric acid đặc nên không có hiện tượng xảy ra.
Bài tập
Bài tập 1: Cho đinh sắt đã được đánh sạch bề mặt vào dung dịch của một trong các muối sau (có nồng độ 1 M): aluminium chloride, zinc nitrate, copper(II) sulfate, lead(II) nitrate.
a) Trường hợp nào có phản ứng tạo thành kim loại? Nêu vai trò của mỗi chất tham gia phản ứng.
b) Viết các phương trình hoá học của phản ứng ở dạng ion thu gọn.
Lời giải:
a) Trường hợp khi cho đinh sắt vào dung dịch: copper(II) sulfate, lead(II) nitrate.
Vai trò: đinh sắt đóng vai trò chất khử; ion Cu2+, ion Pb2+ đóng vai trò chất oxi hóa.
b)
PTHH: Fe + Cu2+ → Fe2+ + Cu
Fe + Pb2+ →Fe2+ + Pb
Bài tập 2: Từ giá trị thế điện cực chuẩn của các cặp oxi hoá − khử ở Bảng 10.1 và giá trị = – 0,413 V ở môi trường trung tính, cho biết phản ứng nào sau đây có thể xảy ra. Viết phương trình hoá học của phản ứng (nếu có).
a) Ag(s) + Cu2+ (aq) →
b) Sn(s) + Cu2+ (aq) →
c) Ni(s) + H₂O(1) →
Lời giải:
Có:
= 0,799 V > = 0,34 V nên phản ứng a không xảy ra.
= −0,138 V < = 0,34 V nên phản ứng b xảy ra.
Sn(s) + Cu2+(aq) ⟶ Sn2+(aq) + Cu(s)
= −0,257 V > = – 0,413 V nên phản ứng c không xảy ra.
Bài tập 3: Dựa vào tính chất vật lí và tính chất hoá học, giải thích vì sao bạc, vàng thường được dùng làm đồ trang sức.
Lời giải:
- Lý do vàng và bạc được thường được dùng làm đồ trang sức:
+ Dựa theo tính chất vật lí: do vàng và bạc có tính dẻo và ánh kim.
+ Dựa theo tính chất hóa học: do vàng và bạc đều không dễ bị oxi hóa trong không khí, không bị han gỉ và không phản ứng với các acid thông thường.
