Mở đầu SGK Hóa 11 Chân trời sáng tạo Bài 1 (trang 5): Trong các phản ứng hóa học, có một loại phản ứng trong đó các chất sản phẩm có khả năng phản ứng tạo để tạo thành các chất đầu. Do vậy, phản ứng xảy ra không hoàn toàn và thường có hiệu suất không cao. Phản ứng tổng hợp Amonia từ Nitrogen và hydrogen thuộc loại phản ứng này. Các phản ứng này được gọi là phản ứng gì? Để tăng hiệu suất của chúng cần điều chỉnh những điều kiện phản ứng như nhiệt độ, áp suất, nồng độ,... như thế nào?
Trả lời:
- Các phản ứng này được gọi là phản ứng thuận nghịch. Người ta thường vận dụng nguyên lí chuyển dịch cân bằng Le Chatelier để chuyển dịch cân bằng theo mong muốn nhằm thu được nhiều sản phẩm hơn và làm tăng hiệu suất phản ứng.
1. Phản ứng một chiều, phản ứng thuận nghịch và cân bằng hóa học
a. Tìm hiểu khái niệm phản ứng một chiều
Câu hỏi 1 SGK Hóa 11 Chân trời sáng tạo Bài 1 (trang 5): Dựa vào phương trình hoá học của phản ứng điều chế khí oxygen từ KMnO4, em hãy cho biết phản ứng có xảy ra theo chiều ngược lại được không.
Trả lời:
Phản ứng điều chế oxygen từ KMnO4: 2KMnO4 K2MnO4 + MnO2 + O2↑
Phản ứng này là phản ứng một chiều do đó phản ứng không xảy ra theo chiều ngược lại (tức K2MnO4, MnO2 và O2 không thể phản ứng được với nhau tạo lại KMnO4).
Luyện tập SGK Hóa 11 Chân trời sáng tạo Bài 1 (trang 5): Viết phương trình hóa học của phản ứng một chiều mà em biết.
Lời giải:
4Cl2 + H2S + 4H2O → 8HCl + H2SO4
Fe3O4 + 8HCl → 2FeCl3 + FeCl2 + 4H2O
b. Tìm hiểu khái niệm phản ứng thuận nghịch
Câu hỏi 2 SGK Hóa 11 Chân trời sáng tạo Bài 1 (trang 6): Phản ứng Cl2 tác dụng với H2O có đặc điểm gì khác với phản ứng nhiệt phân thuốc tím?
Trả lời:
Phương trình hoá học của phản ứng xảy ra khi cho khí Cl2 tác dụng với nước, sản phẩm sinh ra có khả năng phản ứng tạo để tạo thành các chất đầu.
Cl2(aq) + H2O(l) ⇌ HCl(aq) + HClO(aq)
Phản ứng thuận: Cl2 + H2O → HCl + HClO.
Phản ứng nghịch: HCl + HClO → Cl2 + H2O.
Luyện tập 2 SGK Hóa 11 Chân trời sáng tạo Bài 1 (trang 6): Trên thực tế có các phản ứng sau:
2H2 + O2 → 2H2O (1)
2H2O 2H2 + O2 (2)
Vậy có thể viết:
2H2 + O2 ⇌ 2H2O được không? Tại sao?
Lời giải:
Không thể viết 2H2 + O2 ⇌ 2H2O do phản ứng (1) và (2) xảy ra ở hai điều kiện khác nhau.
Chú ý: Phản ứng thuận nghịch được xét trong cùng một điều kiện xác định.
c. Tìm hiểu khái niệm trạng thái cân bằng của phản ứng thuận nghịch
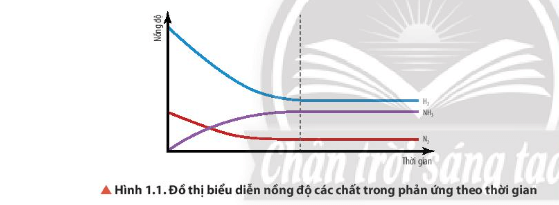
Câu hỏi 3 SGK Hóa 11 Chân trời sáng tạo Bài 1 (trang 6): Quan sát Hình 1.1, nhận xét sự biến thiên nồng độ của các chất trong hệ phản ứng theo thời gian (với điều kiện nhiệt độ không đổi).
Trả lời:
Trong điều kiện nhiệt độ không đổi
- Nồng độ của các chất phản ứng (N2 và H2):
+ Ban đầu, nồng độ giảm dần theo thời gian.
+ Sau đó, nồng độ không thay đổi.
- Nồng độ của sản phẩm (NH3):
+ Ban đầu, nồng độ tăng dần theo thời gian.
+ Sau đó, nồng độ không thay đổi.
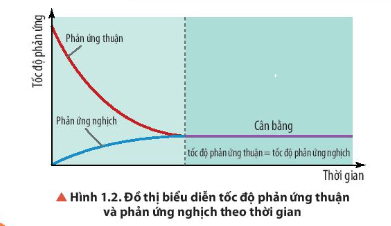
Câu hỏi 4 SGK Hóa 11 Chân trời sáng tạo Bài 1 (trang 6): Quan sát hình 1.2, nhận xét về tốc độ phản ứng thuận và tốc độ phản ứng theo thời gian trong điều kiện nhiệt độ không đổi.
Trả lời:
Do sau một khoảng thời gian nhất định, tốc độ của phản ứng thuận bằng tốc độ của phản ứng nghịch.
2. Hằng số cân bằng của phản ứng thuận nghịch
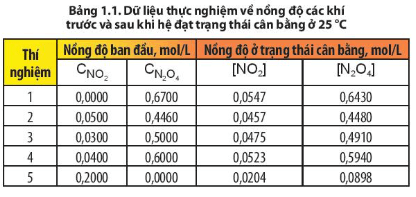
Câu hỏi 5 SGK Hóa 11 Chân trời sáng tạo Bài 1 (trang 7): Sử dụng dữ liệu Bảng 1.1, hãy tính giá trị của biểu thức trong 5 thí nghiệm. Nhận xét giá trị thu được từ các thí nghiệm khác nhau.
Trả lời:
- Thí nghiệm 1:
- Thí nghiệm 2:
- Thí nghiệm 3:
- Thí nghiệm 4:
- Thí nghiệm 5:
Câu hỏi 6 SGK Hóa 11 Chân trời sáng tạo Bài 1 (trang 7): Viết các biểu thức tính tốc độ phản ứng thuận và tốc độ phản ứng nghịch của phản ứng thuận nghịch sau, biết phản ứng thuận và phản ứng nghịch đều là phản ứng đơn giản
aA + bB ⇌ cC + dD
Lập tỉ lệ giữa hằng số tốc độ phản ứng thuận và hằng số tốc độ phản ứng nghịch ở trạng thái cân bằng.
Trả lời:
Biểu thức tính tốc độ phản ứng thuận: vt=kt[A]a[B]b
Biểu thức tính tốc độ phản ứng nghịch: vn=kn[C]c[D]d
Ở trạng thái cân bằng vt= vn ⇔ kt[A]a[B]b = kn[C]c[D]d
Luyện tập SGK Hóa 11 Chân trời sáng tạo Bài 1 (trang 7): Cho hệ cân bằng sau: 2SO2(g) + O2(g) → 2SO3(g)
Viết biểu thức tính hằng số cân bằng KC của phản ứng trên.
Lời giải:
Hằng số cân bằng:
3. Sự chuyển dịch cân bằng hóa học
Câu hỏi 7 SGK Hóa 11 Chân trời sáng tạo Bài 1 (trang 7): Nêu hiện tượng xảy ra trong Thí nghiệm 1, từ đó cho biết chiều chuyển dịch cân bằng của phản ứng trong bình 2 và bình 3.
- Hiện tượng:
+ Màu của hỗn hợp khí trong bình 2 nhạt dần.
+ Màu của hỗn hợp khí trong bình 3 đậm dần.
- Nhận xét:
2NO2(g) ⇌ N2O4(g)
(màu nâu đỏ) (không màu)
+ Cân bằng trong bình 2 chuyển dịch theo chiều thuận;
+ Cân bằng trong bình 3 chuyển dịch theo chiều nghịch.
Câu hỏi 8 SGK Hóa 11 Chân trời sáng tạo Bài 1 (trang 8): Nhận xét hiện tượng xảy ra trong thí nghiệm 2
Trả lời:
Hiện tượng: Bình 1 làm phenolphthalein chuyển màu hồng --> có sinh ra NaOH --> phản ứng xảy ra theo chiều thuận
Câu hỏi 9 SGK Hóa 11 Chân trời sáng tạo Bài 1 (trang 8): Khi đun nóng, phản ứng trong bình (1) chuyển dịch theo chiều nào?
Trả lời:
- Khi đun nóng, phản ứng thủy phân diễn ra tạo NaOH làm hoa hồng chỉ thị phenolphthalein. Phản ứng chuyển dịch theo chiều thuận.
4. Các yếu tố ảnh hưởng đến cân bằng hóa học
a. Tìm hiểu ảnh hưởng của nhiệt độ đến cân bằng hóa học
Câu hỏi 10 SGK Hóa 11 Chân trời sáng tạo Bài 1 (trang 9): Cho biết chiều nào của phản ứng (1) là chiều thu nhiệt và chiều nào là chiều toả nhiệt.
Trả lời:
Phản ứng (1): 2NO2(g) ⇌ N2O4(g)
(màu nâu đỏ) (không màu)
< 0.
Vậy ở phản ứng (1), chiều thuận toả nhiệt, chiều nghịch thu nhiệt.
Câu hỏi 11 SGK Hóa 11 Chân trời sáng tạo Bài 1 (trang 9): Từ hiện tượng ở thí nghiệm 1, cho biết khi làm lạnh bình (2) và khi làm nóng bình (3) thì cân bằng trong mỗi bình chuyển dịch theo chiều toả nhiệt hay thu nhiệt.
Trả lời:
Khi làm lạnh bình (2) cân bằng chuyển dịch theo chiều phản ứng tỏa nhiệt (giảm tác động giảm nhiệt độ).
Khi làm nóng bình (3) cân bằng chuyển dịch theo chiều phản ứng thu nhiệt (giảm tác động tăng nhiệt độ).
b. Tìm hiểu ảnh hưởng của áp suất đến cân bằng hóa học
Câu hỏi 12 SGK Hóa 11 Chân trời sáng tạo Bài 1 (trang 9): Khi đẩy hoặc kéo pít-tông thì số mol khí của hệ (2) thay đổi như thế nào?
Trả lời:
2NO2(g) ⇌ N2O4(g) (2)
(nâu đỏ) (không màu)
Khi đẩy pít-tông, áp suất của hệ tăng, thể tích của hệ giảm, số mol khí của hệ (2) giảm.
Khi kéo pít-tông, áp suất của hệ giảm, thể tích của hệ tăng, số mol khí của hệ (2) tăng.
Luyện tập SGK Hóa 11 Chân trời sáng tạo Bài 1 (trang 9): Phản ứng tổng hợp ammonia: N2(g) + 3H2(g) 2NH3(g)
Để thu được NH3 với hiệu suất cao, cần điều chỉnh áp suất như thế nào?
Trả lời:
Trong phản ứng tổng hợp ammonia, khi tăng áp suất cân bằng sẽ chuyển dịch theo chiều làm giảm áp suất tức chiều làm giảm số mol khí, hay chiều thuận.
Như vậy để thu được NH3 với hiệu suất cao, cần điều chỉnh áp suất cao. Thực tế, phản ứng tổng hợp NH3 ở các nhà máy thường được thực hiện ở áp suất 200 – 300 bar.
c. Tìm hiểu ảnh hưởng của nồng độ đến cân bằng hóa học
Câu hỏi 13 SGK Hóa 11 Chân trời sáng tạo Bài 1 (trang 10): Hãy cho biết cân bằng chuyển dịch theo chiều nào khi thêm một lượng khí CO vào hệ cân bằng (3).
Trả lời:
Hệ cân bằng (3): C(s) + CO2(g) ⇌ 2CO(g)
Khi thêm một lượng khí CO vào hệ cân bằng (3) cân bằng sẽ chuyển dịch theo chiều làm giảm CO hay chiều nghịch.
Vận dụng SGK Hóa 11 Chân trời sáng tạo Bài 1 (trang 10): Trong các hang động đá vôi thường xảy ra hiện tượng hình thành thạch nhũ và xâm thực của nước mưa vào đá vôi theo phương trình hóa học sau
CaCO3 + H2O + CO2 ⇌ Ca(HCO3)2
Hãy giải thích các quá trình này.
Lời giải:
- Phản ứng xảy ra theo chiều thuận giải thích sự xâm thực đá vôi của nước mưa do Nước mưa khí quyển có chứa CO2 sẽ hòa tan rất mạnh các khoáng vật thuộc nhóm carbonate, sulfate, chuyển thành Calcium carbonate.
- Phản ứng xảy ra theo chiều nghịch giải thích sự tạo thành thạch nhũ trong các hang động do khi Calcium hydrogencarbonate hòa tan trong nước đi xuống theo các kẽ nứt, tới trần hang gặp chướng ngại vật, nhỏ giọt rơi xuống đáy hang.
- Do tiếp xúc với không khí trong hang có nhiệt độ cao nên xảy ra phản ứng nghịch chuyển thành Calcium carbonate, carbon dioxide và hơi nước. Calcium carbonate là chất khó hòa tan nên tách ra khỏi dung dịch và kết tủa lại nơi giọt nước rơi xuống, cứ thế tạo thành các nhũ đá trên trần hang có hình nón lộn ngược.
Bài tập
Bài tập 1 SGK Hóa 11 Chân trời sáng tạo Bài 1 (trang 11): Hằng số cân bằng KC của một phản ứng thuận nghịch phụ thuộc vào yếu tố nào sau đây?
A. Nồng độ.
B. Nhiệt độ.
C. Áp suất.
D. Chất xúc tác.
Lời giải:
Trong phản ứng thuận nghịch, hằng số cân bằng KC của phản ứng xác định chỉ phụ thuộc vào nhiệt độ.
→ Chọn B.
Bài tập 2 SGK Hóa 11 Chân trời sáng tạo Bài 1 (trang 11): Yếu tố nào sau đây luôn luôn không làm dịch chuyển cân bằng của hệ phản ứng?
A. Nhiệt độ.
B. Áp suất.
C. Nồng độ.
D. Chất xúc tác.
Đáp án đúng: D
- Chất xúc tác không làm thay đổi nồng độ các chất trong hệ cân bằng và cũng không làm thay đổi hằng số cân bằng nên không làm chuyển dịch cân bằng.
Bài tập 3 SGK Hóa 11 Chân trời sáng tạo Bài 1 (trang 11): Viết biểu thức tính KC cho các phản ứng sau
(1) CaCO3(s) ⇌ CaO(s) + CO2(g)
(2) Cu2O(s) + O2(g) ⇌ 2CuO(s)
Lời giải:
(1)
(2)
Bài tập 4 SGK Hóa 11 Chân trời sáng tạo Bài 1 (trang 11): Xét các hệ cân bằng sau trong một bình kín:
a) C(s) + H2O(g) ⇌ CO(g) + H2(g)
b) CO(g) + H2O(g) ⇌ CO2(g) + H2(g)
Các cân bằng trên dịch chuyển theo chiều nào khi thay đổi một trong các điều kiện sau?
(1) Tăng nhiệt độ.
(2) Thêm một lượng hơi nước vào hệ.
(3) Thêm khí H2 vào hệ.
(4) Tăng áp suất chung bằng cách nén cho thể tích của hệ giảm xuống.
(5) Dùng chất xúc tác.
Lời giải:
a) C(s) + H2O(g) ⇌ CO(g) + H2(g)
(1) Tăng nhiệt độ cân bằng chuyển dịch theo chiều phản ứng thu nhiệt tức chiều thuận.
(2) Thêm một lượng hơi nước vào hệ, cân bằng chuyển dịch theo chiều làm giảm lượng hơi nước tức chiều thuận.
(3) Thêm khí H2 vào hệ, cân bằng chuyển dịch theo chiều làm giảm lượng H2 tức chiều nghịch.
(4) Tăng áp suất chung bằng cách nén cho thể tích của hệ giảm xuống cân bằng chuyển dịch theo chiều giảm số mol khí thức chiều nghịch.
(5) Dùng chất xúc tác không làm cân bằng chuyển dịch.
b) CO(g) + H2O(g) ⇌ CO2(g) + H2(g)
(1) Tăng nhiệt độ cân bằng chuyển dịch theo chiều phản ứng thu nhiệt tức chiều nghịch.
(2) Thêm một lượng hơi nước vào hệ, cân bằng chuyển dịch theo chiều làm giảm lượng hơi nước tức chiều thuận.
(3) Thêm khí H2 vào hệ, cân bằng chuyển dịch theo làm giảm lượng H2 tức chiều nghịch.
(4) Tăng áp suất chung bằng cách nén cho thể tích của hệ giảm xuống không làm cân bằng chuyển dịch do hệ cân bằng có tổng hệ số tỉ lượng của các chất khí ở hai vế của phương trình hoá học bằng nhau.
(5) Dùng chất xúc tác không làm cân bằng chuyển dịch.
Bài tập 5 SGK Hóa 11 Chân trời sáng tạo Bài 1 (trang 11): Cho phản ứng sau COCl2 ⇌ Cl2 + CO Kc = 8,2 .10 −2 ở 900k
Tại trạng thái cân bằng nếu nồng độ CO và Cl2 đều bằng 0,15 M thì nồng độ độ COCl2 là bao nhiêu?
Lời giải:
Ta có biểu thức:
