Mở đầu SGK Hóa 11 Chân trời sáng tạo Bài 3 (trang 20): Nitrogen là khí có hàm lượng lớn nhất trong không khí, có vai trò cung cấp đạm tự nhiên cho cây trồng. Nitrogen có tính chất gì và có những ứng dụng nào trong cuộc sống?
Trả lời:
- Tính chất của Nitrogen:
+ Tính chất vật lý: Ở điều kiện thường nitrogen là chất khí không màu, không mùi, không vị, nhẹ hơn không khí, hóa lỏng ở -196 oC, hóa rắn ở -210 oC, rất ít tan trong nước.
+ Tính chất hóa học: Phân tử nitrogen bền, khá trơ về mặt hóa học, ở điều kiện thích hợp, nitrogen chủ yếu thể hiện tính oxi hóa và thể hiện tính khử khi phản ứng với oxygen.
1. Trạng thái tự nhiên
Câu hỏi 1 SGK Hóa 11 Chân trời sáng tạo Bài 3 (trang 20): Quan sát hình 3.1, cho biết trong không khí, khí nào chiếm tỉ lệ thể tích lớn nhất?

Trả lời:
- Khí chiếm tỉ lệ thể tích lớn nhất là nitrogen (khoảng 78%)
Câu hỏi 2 SGK Hóa 11 Chân trời sáng tạo Bài 3 (trang 20): Ngoài đơn chất nitrogen, thì nguyên tố nitrogen còn tồn tại dưới dạng nào? Lấy ví dụ.
Trả lời:
- Ngoài đơn chất nitrogen, thì nguyên tố nitrogen còn tồn tại dưới dạng hợp chất.
+ Ví dụ: Khoáng vật sodium nitrate, protein, nucleic acid,…
2. Tính chất vật lí
Câu hỏi 3 SGK Hóa 11 Chân trời sáng tạo Bài 3 (trang 21): Quan sát Hình 3.2, nêu hiện tượng xảy ra. Giải thích.
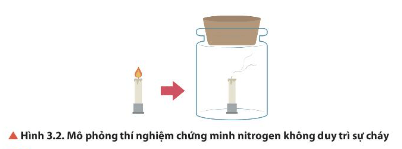
Trả lời:
Hiện tượng: Cây nến đang cháy ngoài không khí bị tắt khi đưa vào bình chứa khí nitrogen.
Giải thích: Khí nitrogen không duy trì sự cháy.
Câu hỏi 4 SGK Hóa 11 Chân trời sáng tạo Bài 3 (trang 21): Nitrogen nặng hay nhẹ hơn không khí. Tại sao?
Trả lời:
- Nitrogen nhẹ hơn không khí do dN2/kk = 28/29 <1
Luyện tập SGK Hóa 11 Chân trời sáng tạo Bài 3 (trang 21): Người ta có thể thu khí nitrogen trong phòng thí nghiệm bằng phương pháp đẩy nước. Hãy giải thích điều này.
Lời giải:
- Người ta có thể thu khí nitrogen trong phòng thí nghiệm bằng phương pháp đẩy nước vì ở điều kiện thường khí nitrogen tan rất ít trong nước.
3. Tính chất hóa học
Câu hỏi 5 SGK Hóa 11 Chân trời sáng tạo Bài 3 (trang 21): Quan sát Hình 3.3 và từ dữ kiện năng lượng liên kết trong phân tử N2, dự đoán về độ bền phân tử và khả năng phản ứng của nitrogen ở nhiệt độ thường.

Trả lời:
- Liên kết ba giữa hai nguyên tử N trong phân tử nitrogen có năng lượng liên kết rất lớn (945 kJ/mol) nên rất khó bị phá vỡ. Do đó, ở nhiệt độ thường phân tử nitrogen rất bền, khá trơ về mặt hoá học.
Câu hỏi 6 SGK Hóa 11 Chân trời sáng tạo Bài 3 (trang 21): Xác định tính oxi hóa, tính khử của nitrogen trong phản ứng N2 với H2 và với O2. Cho biết phản ứng này thu nhiệt hay tỏa nhiệt?
Trả lời:
Khi tác dụng với H2: N2 đóng vai trò là chất oxi hóa, phản ứng toả nhiệt
H2(g)+N2(g) ⇌ NH3(g) (to,xt,p) (số oxi hoá của N: 0 → -3)
Khi phản ứng với O2: N2 đóng vai trò là chất khử, phản ứng thu nhiệt
N2(g)+ O2(g) ⇌ 2NO(g) (to) (số oxi hoá của N: 0 → +2)
4. Quá trình tạo và cung cấp nitrate cho đất từ nước mưa
Câu hỏi 7 SGK Hóa 11 Chân trời sáng tạo Bài 3 (trang 22): Quan sát Hình 3.4, cho biết con người có thể can thiệp vào chu trình của nitrogen trong tự nhiên bằng cách nào. Nếu sự can thiệp đó vượt ngưỡng cho phép thì ảnh hưởng gì đến môi trường?
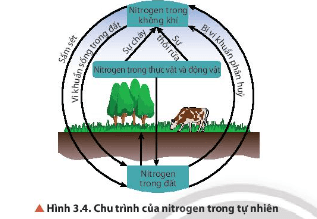
Trả lời:
- Con người có thể can thiệp vào chu trình của nitrogen trong tự nhiên bằng cách: sản xuất phân đạm, thải ra môi trường khí thải công nghiệp, khí thải động cơ chứa oxide của nitrogen.
- Nếu sự can thiệp đó vượt ngưỡng cho phép sẽ gây ô nhiễm môi trường đất, nước, không khí, ảnh hưởng đến sức khỏe con người, sinh ra mưa acid.
5. Ứng dụng
Câu hỏi 8 SGK Hóa 11 Chân trời sáng tạo Bài 3 (trang 23): Quan sát Hình 3.5 và dựa vào các tính chất của nitrogen, hãy giải thích vì sao nitrogen có những ứng dụng đó.

Trả lời:
Ứng dụng của khí nitrogen:
+ Trong sản xuất rượu, bia khí nitrogen được bơm vào các bể chứa để loại bỏ khí oxygen.
+ Trong công nghệ đóng gói thực phẩm, khí nitrogen được bơm vào túi để loại bỏ khí oxygen và làm phồng bao bì.
+ Trong chữa cháy, nitrogen được dùng để dập tắt các đám cháy do hoá chất, chập điện…
+ Trong lĩnh vực y tế, nitrogen lỏng được dùng để bảo quản máu, tế bào, dịch cơ thể, trứng, tinh trùng …
+ Trong khai thác dầu khí, hỗn hợp chứa N2 và CO2 được bơm vào bể chứa dầu mỏ để tạo áp suất đẩy dầu dư bị kẹt lại lên trên nhờ đặc tính nén cao.
Các ứng dụng của khí nitrogen dựa vào tính trơ của nó.
Vận dụng SGK Hóa 11 Chân trời sáng tạo Bài 3 (trang 23): Giải thích vì sao người ta bơm khí nitrogen vào trong những loại vaccin
Lời giải:
- Do khí nitrogen là một loại khí tương đối trơ ở nhiệt độ phòng nên được sử dụng để làm chậm quá trình phân hủy của một số chất trong vaccin.
Bài tập
Bài tập 1 SGK Hóa 11 Chân trời sáng tạo Bài 3 (trang 23): Trình bày cấu tạo của phân tử N2. Giải thích vì sao ở điều kiện thường, N2 khá trơ về mặt hoá học.
Lời giải:
- Trong phân tử nitrogen có liên kết ba bền vững với năng lượng liên kết lớn (945 kJ/mol).
- Để xảy ra phản ứng hóa học, cần cung cấp một lượng lớn năng lượng để phá hủy liên kết ba bền vững trong phân tử nitrogen. Do đó ở nhiệt độ thường, liên kết ba trong phân tử nitrogen khó bị phá vỡ, nên N2 khá trơ về mặt hóa học (khó phản ứng hóa học).
Bài tập 2 SGK Hóa 11 Chân trời sáng tạo Bài 3 (trang 23): Viết phương trình hoá học chứng minh tính oxi hoá và tính khử của nitrogen. Cho biết số oxi hoá của nitrogen thay đổi như thế nào trong các phản ứng hoá học đó.
Lời giải:

Bài tập 3 SGK Hóa 11 Chân trời sáng tạo Bài 3 (trang 23): Dựa vào giá trị năng lượng liên kết (Eb), hãy dự đoán ở điều kiện thường đơn chất nào (nitrogen, hydrogen, oxygen, chlorine) khó và dễ tham gia phản ứng hóa học nhất. Vì sao?
a) N2(g) → 2N(g) Eb= 945 kJ/mol
b) H2(g) → 2H(g) Eb=432 kJ/mol
c) O2 (g) → 2O(g) Eb=498 kJ/mol
d) Cl2 (g) → 2Cl(g) Eb= 243 kJ/mol
Lời giải:
- Năng lượng liên kết càng lớn thì liên kết càng bền → càng khó tham gia phản ứng hóa học
- Trong 4 đơn chất trên Cl2 dễ tham gia phản ứng hóa học nhất, N2 khó tham gia phản ứng hóa học nhất.
