Mở đầu: Pháo hoa thường được sử dụng trong các dịp lễ, Tết. Để tạo màu cho pháo hoa, người ta dùng một số muối hay oxide kim loại, trong đó có hợp chất kim loại nhóm IA như lithium carbonate tạo màu đỏ, sodium nitrate tạo màu vàng,… Kim loại nhóm IA và hợp chất của chúng có những tính chất và ứng dụng nào?
Lời giải:
* Kim loại nhóm IA:
- Tính chất vật lí: Kim loại nhóm IA có ánh kim, dẫn điện tốt, nhiệt độ nóng chảy và nhiệt độ sôi thấp, khối lượng riêng nhỏ, độ cứng tương đối thấp.
- Tính chất hoá học: Kim loại nhóm IA có tính khử mạnh, tính khử tăng dần từ Li đến Cs.
* Một số hợp chất của kim loại nhóm IA:
- Sodium chloride (NaCl): là chất rắn, không màu; có vai trò quan trọng trong thực phẩm, nông nghiệp, công nghiệp, chăn nuôi, y tế và trong cuộc sống hàng ngày của con người.
- Sodium hydrogencarbonate (NaHCO3): là chất rắn, màu trắng, bền ở nhiệt độ thường, bị phân huỷ khi đun nóng; NaHCO3 có thể tác dụng được với cả dung dịch acid và dung dịch kiềm. Về ứng dụng, NaHCO3 được sử dụng trong chế biến thực phẩm, sản xuất thuỷ tinh; trong y học, NaHCO3 được sử dụng để làm giảm chứng đau dạ dày do dư acid, điều trị các chứng viêm loét dạ dày hoặc tá tràng …
- Sodium carbonate (Na2CO3): là chất rắn màu trắng, dễ tan trong nước; Na2CO3 bị thuỷ phân trong dung dịch cho môi trường kiềm. Về ứng dụng, một lượng lớn Na2CO3 được sử dụng trong công nghiệp thuỷ tinh. Ngoài ra, Na2CO3 còn được dùng trong xử lí nước, sản xuất xà phòng, chất tẩy rửa, thuốc, phụ gia thực phẩm …
A. Đơn chất
1. Vị trí, cấu tạo và trạng thái tự nhiên
Thảo luận 1: Dựa vào cấu hình electron và bán kính nguyên tử (Bảng 17.1), hãy giải thích trong các hợp chất, kim loại nhóm IA đều thể hiện số oxi hoá +1.
Lời giải:
- Trong các hợp chất, kim loại nhóm IA đều thể hiện số oxi hoá +1 vì cấu hình electron của các kim loại này đều có 1 electron lớp ngoài cùng nên nó dễ dàng nhường 1 electron này đi để đạt trạng thái bão hoà.
Thảo luận 2: Giải thích tại sao trong tự nhiên kim loại nhóm IA chỉ tồn tại ở dạng hợp chất.
Lời giải:
- Vì kim loại nhóm IA có giá trị thế điện cực chuẩn rất nhỏ nên các kim loại nhóm IA có tính khử mạnh hay nói cách khác là kim loại nhóm IA hoạt động hóa học mạnh, chúng dễ dàng kết hợp với những chất khác để tạo thành hợp chất. Do đó trong tự nhiên kim loại nhóm lA chỉ tồn tại ở dạng hợp chất.
2. Tính chất vật lí
Thảo luận 3: Dựa vào Bảng 17.2, nêu xu hướng biến đổi nhiệt độ nóng chảy, nhiệt độ sôi của các kim loại nhóm IA từ Li đến Cs.
Lời giải:
Trong nhóm IA, đi từ Li đến Cs:
+ Nhiệt độ nóng chảy giảm dần;
+ Nhiệt độ sôi giảm dần.
Luyện tập: Vì sao kim loại nhóm IA có khối lượng riêng nhỏ và độ cứng thấp?
Lời giải:
- Kim loại nhóm IA có khối lượng riêng nhỏ vì nguyên tử của các kim loại nhóm IA có bán kính lớn, cấu trúc mạng tinh thể kém đặc khít.
- Kim loại nhóm IA có độ cứng thấp vì các ion kim loại liên kết với nhau bằng liên kết kim loại yếu.
3. Tính chất hoá học
Thảo luận 4: Dựa vào cấu hình electron nguyên tử và giá trị thế điện cực chuẩn, dự đoán tính chất hoá học đặc trưng của kim loại nhóm IA.
Lời giải:
- Tính chất hoá học đặc trưng của kim loại nhóm IA là tính khử mạnh.
Thảo luận 5: Khi cắt mẩu sodium ở trong không khí, bề mặt vừa cắt có ánh kim lập tức mờ đi. Giải thích. Hãy dự đoán hiện tượng xảy ra khi cắt kim loại lithium, potassium trong không khí.
Lời giải:
Khi cắt mẩu sodium ở trong không khí, bề mặt vừa cắt có ánh kim lập tức mờ đi do lớp sodium ở bề mặt vết cắt ngay lập tức phản ứng với các tác nhân có trong không khí như oxygen, hơi nước …
4Na + O2 → 2Na2O
2Na + 2H2O → 2NaOH + H2
Hiện tượng khi cắt kim loại lithium, potassium trong không khí cũng xảy ra tương tự như khi cắt mẩu sodium ở trong không khí: bề mặt vừa cắt có ánh kim lập tức mờ đi.
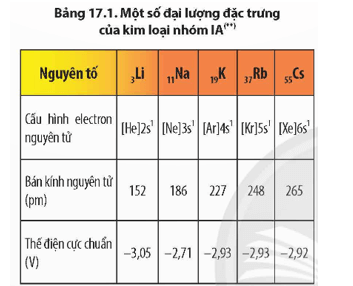
Luyện tập: Viết phương trình hoá học của các phản ứng sau (viết tên sản phẩm):
a) Li + O2 →
b) Na + Cl2 →
c) K + Br2 →
Lời giải:
Thảo luận 6: Tại sao để bảo quản kim loại Na, K người ta ngâm chúng trong dầu hoả? Li có dùng cách này được không? Giải thích.
Lời giải:
- Để bảo quản kim loại Na, K người ta ngâm chúng trong dầu hoả vì Na, K có tính khử mạnh, phản ứng mạnh với nước ở điều kiện thường.
- Không thể dùng cách đo để bảo quản Li vì Li gặp dầu hoả sẽ nổi lên và bốc cháy.
Thảo luận 7: Kim loại nhóm IA hoạt động hoá học mạnh. Tại sao?
Lời giải:
Kim loại nhóm IA hoạt động hoá học mạnh do có thế điện cực chuẩn rất nhỏ.
Thảo luận 8: Kim loại nhóm IA phản ứng dễ dàng với oxygen và nước, mức độ mãnh liệt của phản ứng tăng dần từ Li đến K. Giải thích.
Lời giải:
- Trong cùng nhóm IA, tính kim loại (tính khử) tăng dần từ Li đến K nên mức độ mãnh liệt của phản ứng giữa các kim loại nhóm IA với oxygen và nước cũng tăng dần từ Li đến K.
B. Hợp chất
2. Nhận biết các ion Li+, Na+, K+
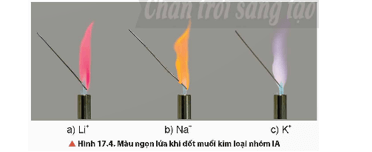
Thảo luận 9: Quan sát thí nghiệm thử màu ngọn lửa, nêu hiện tượng quan sát được. Rút ra kết luận.
Lời giải:
Hiện tượng:
+ Muối của lithium cháy cho ngọn lửa màu đỏ tía.
+ Muối của sodium cháy cho ngọn lửa màu vàng.
+ Muối của potassium cháy cho ngọn lửa màu tím nhạt.
Kết luận: Có thể nhận biết ion kim loại kiềm bằng cách thử màu ngọn lửa.
Luyện tập: Dung dịch của mỗi chất sau đều không màu: NaCl, Na2SO4, KCl, LiNO3. Hãy đề xuất cách phân biệt các dung dịch trên.
Lời giải:
- Đầu tiên, đốt cháy các muối trên, ta phân biệt được các muối qua màu sắc của ngọn lửa: muối Na cho màu vàng; muối K cho màu tím nhạt và muối Li cho màu đỏ tía.
- Tiếp đến là dùng dung dịch BaCl2 để phân biệt muối NaCl và Na2SO4. Khi đó trong ống nghiệm chứa dung dịch Na2SO4 có kết tủa trắng, còn ống nghiệm chứa NaCl không có hiện tượng xảy ra. PTHH: BaCl2 + Na2SO4 → BaSO4↓ + 2NaCl
4. Điện phân dung dịch sodium chloride
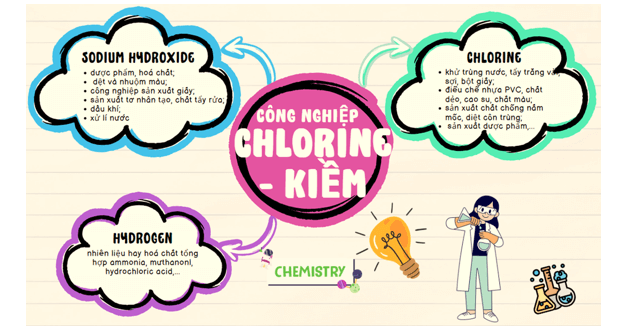
Thảo luận 10: Sử dụng sơ đồ tư duy, trình bày các sản phẩm cơ bản của công nghiệp chlorine – kiềm và ứng dụng quan trọng của chúng.
Lời giải:
Học sinh vẽ sơ đồ tư duy theo ý tưởng của mình. Có thể tham khảo sơ đồ tư duy sau (nguồn Internet):
5. Sodium hydrogencarbonate, sodium carbonate
Thảo luận 11: Giải thích tại sao NaHCO3 được dùng làm bột nở.
Lời giải:
- NaHCO3 được dùng làm bột nở vì khi gặp nhiệt độ cao, NaHCO3 dễ bị nhiệt phân làm sinh ra chất khí và hơi làm tăng thể tích và tạo độ xốp cho bánh.
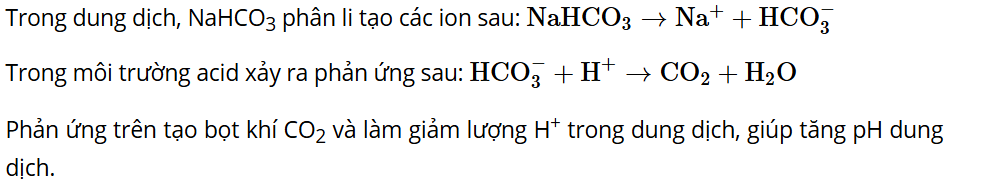
Vận dụng: NaHCO3 dùng để tạo bọt và tăng pH trong các loại thuốc sủi bọt. Hãy tìm hiểu và giải thích.
Lời giải:
Thảo luận 12: Vì sao phương pháp Solvay được gọi là phương pháp tuần hoàn ammonia. Nêu những ưu điểm của phương pháp.
Lời giải:
- Phương pháp Solvay được gọi là phương pháp tuần hoàn ammonia vì phương pháp này có sự quay vòng các sản phẩm trung gian (như CO2 và NH3) để tái sử dụng trong quy trình sản xuất.
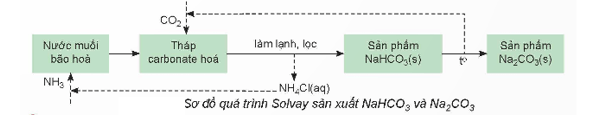
- Ưu điểm của phương pháp Solvay:
+ Sử dụng nguồn nguyên liệu dễ tìm trong tự nhiên là muối ăn (NaCl), đá vôi (CaCO3) và ammonia (NH3).
+ Giảm thiểu được tác động đến môi trường bằng cách quay vòng các sản phẩm trung gian (như CO2 và NH3) để tái sử dụng trong quy trình sản xuất.
+ Sản phẩm thu được NaHCO3 và Na2CO3 có độ tinh khiết cao.
Luyện tập: Hãy vẽ sơ đồ tổng hợp Na2CO3 theo phương pháp Solvay.
Lời giải:
Sơ đồ tổng hợp Na2CO3 theo phương pháp Solvay:
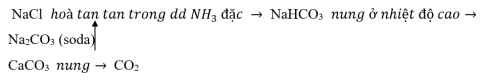
Bài tập
Bài tập 1: Phương pháp điều chế NaOH trong công nghiệp là
A. cho kim loại Na tác dụng với nước.
B. cho Na2O tác dụng với nước.
C. điện phân dung dịch NaCl bão hoà có màng ngăn.
D. điện phân dung dịch NaCl bão hoà, không có màng ngăn.
Đáp án: C
Phương pháp điều chế NaOH trong công nghiệp là điện phân dung dịch NaCl bão hoà có màng ngăn.
Bài tập 2: Viết phương trình hoá học của phản ứng khi cho potassium tác dụng với chlorine. Sản phẩm của phản ứng có tan tốt trong nước không? Tìm hiểu một số ứng dụng của nó.
Lời giải:

Bài tập 3: Viết phương trình hoá học của phản ứng xảy ra trong các thí nghiệm sau:
a) Cho một mẩu kim loại sodium vào cốc nước.
b) Sục khí CO2 vào dung dịch KOH.
c) Nhỏ dung dịch HCl vào ống nghiệm có chứa sẵn Na2CO3.
d) Nhỏ dung dịch HCl vào ống nghiệm có chứa sẵn KHCO3.
e) Cho một lượng NaHCO3 rắn vào ống nghiệm rồi đun nóng trên ngọn lửa đèn cồn.
Lời giải:
Các phương trình hoá học xảy ra:
a) 2Na + 2H2O → 2NaOH + H2.
b) CO2 + 2KOH → K2CO3 + H2O.
c) 2HCl + Na2CO3 → 2NaCl + CO2 + H2O.
d) HCl + KHCO3 → KCl + CO2 + H2O.
e) 2NaHCO3 Na2CO3 + CO2 + H2O.