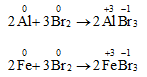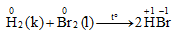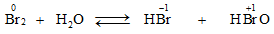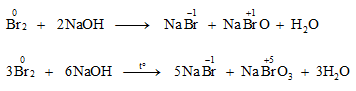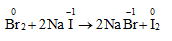1. Brom (Br) là gì?
- Brom là một nguyên tố hóa học thuộc nhóm halogen (nhóm VIIA), chu kỳ 4 trong bảng tuần hoàn.

- Số hiệu nguyên tử: 35
- Trong tự nhiên, Brom tồn tại ở dạng lỏng màu nâu đỏ, dễ bay hơi với mùi khó chịu và độc hại. Brom ít tan trong nước nhưng tan tốt trong dung môi hữu cơ như etanol, benzen…
- Brom (Br) có thể có các hóa trị -1, +1, +3, +5 và +7. Tuy nhiên, hóa trị chính thường được sử dụng cho brom là -1, khi nó tạo thành ion Bromide (Br-) trong các hợp chất.
- Ion Bromide là ion âm có 8 electron (đạt cấu hình electron của khí hiếm argon), và nó thường kết hợp với các ion dương khác để tạo thành các hợp chất ion. Ví dụ, trong muối Sodium bromide (NaBr), Bromine có số oxi hoá -1. Các số oxi hoá khác của Bromine (+1, +3, +5 và +7) ít phổ biến hơn và thường xuất hiện trong các hợp chất không phổ biến hoặc trong các điều kiện đặc biệt.
2. Brom có nguyên tử khối là bao nhiêu?
- Nguyên tử khối của Brom được xác định là 79,904 u.
- Hàm lượng brom trong tự nhiên khá hiếm trong vỏ Trái Đất, ít hơn nhiều so với clo và flo.
3. Tính chất lý hóa của Brom
Tính chất vật lý
- Ở điều kiện bình thường, brom là chất lỏng, dễ bay hơi, có màu nâu đỏ.
- Brom ít tan trong nước, tan nhiều trong dung môi hữu cơ như benzene hay cacbon tetraclorua.
- Brom và hơi brom độc, rơi vào da có thể gây bỏng nặng.
Tính chất hóa học
Tác dụng với kim loại
- Brom oxi hóa được hầu hết kim loại, trừ Au, Pt
Tác dụng với hiđro
- Brom tác dụng với hiđro khi đun nóng (không gây nổ), phản ứng tỏa nhiệt nhưng ít hơn so với phản ứng của clo.
Tác dụng với nước và với dung dịch kiềm
- Brom phản ứng với nước tương tự như clo nhưng kém hơn
- Khi tác dụng với kiềm:
Tác dụng với muối của các halogen khác
- Halogen mạnh đẩy halogen yếu hơn ra khỏi dung dịch muối
Tác dụng với clo trong nước
4. Phương pháp điều chế Brom được sử dụng hiện nay
- Brom có nhiều nhất trong nước biển nên nguồn chính để điều chế brom chính là nước biển. Sau khi đã lấy muối ăn Natri Clorua ra khỏi nước biển, phần còn lại chứa nhiều muối bromua của kali và natri. Sục khí clo qua dung dịch này, ta thu được Brom theo phản ứng hóa học sau:5. Ứng dụng của Br (Bromine)
- Được sử dụng như một chất chống cháy. Chất chống cháy brom hoá được dùng làm chất ngăn chặn hoặc làm chậm quá trình phát lửa do chất dẻo.
- Nó cũng được sử dụng trong nông nghiệp. Các hợp chất Brom hữu cơ được sử dụng làm thuốc trừ sinh vật gây hại, diệu sâu bỏ và diệt cả các loài gậm nhấm.
- Dùng làm phụ gia xăng dầu. Tuy nhiên lượng brom sử dụng cho lĩnh vực này có xu hướng giảm dần trong thời gian gần đây.
- Một công dụng khác có thể ít được biết đến của Brom là dùng để khử trùng bể bơi mái che. Dùng chúng để khử trùng có hiệu quả hơn so với các thuốc khử trùng khác.
- Được sử dụng trong dược phẩm, sản xuất thuốc nhuộm, mực in và làm thuốc hiện hình trong nghề ảnh.
- Brom cũng được dùng để khoan dầu. Các hợp chất bromua dạng lỏng được sử dụng làm dung dịch khoan ở những giếng khoan sâu và có áp suất cao.